Reporte de un caso
La paciente era una mujer de 23 años que presentó en 2010 nuevos dolores de cabeza y se sometió a una resección quirúrgica de un PXA paramédico frontal posterior izquierdo (grado 2 de la OMS). Cuando hubo recidiva aproximadamente 2 años más tarde se sometió a una resección seguida de radiación a 56 Gy. Se sometió a una tercera resección cuando hubo recidiva aproximadamente 2 años después. El tumor se mantuvo en grado 2 y se encontró que albergaba la mutación V600E BRAF y MGMTmetilación del promotor. La craneotomía fue seguida por nueve ciclos de temozolomida. Aproximadamente 1 año después, se sometió a una cuarta craneotomía por enfermedad progresiva. En ese momento, el paciente comenzó un régimen de terapias alternativas fuera de nuestras instituciones. En 6 meses, hubo una mayor progresión tumoral. En ese momento, el tratamiento con un inhibidor de BRAF se discutió con el paciente. Aunque se explicaron los motivos subyacentes, el paciente y la familia declinaron debido a las preocupaciones de los efectos secundarios. Sin embargo, ella acordó bevacizumab, y el tumor inicialmente mostró una respuesta radiográfica. Sin embargo, hubo una progresión tumoral adicional aproximadamente 5 meses después de comenzar el tratamiento con bevacizumab.
El paciente acordó el tratamiento con inhibidor de BRAF y se inició vemurafenib a una dosis de 960 mg cada 12 h. Debido a la naturaleza recurrente múltiple del tumor, según la solicitud del paciente y la familia, se añadió TTF al régimen. El paciente logró una respuesta parcial marcada con una reducción del 70% del tumor potenciador después de 2 meses con la combinación de vemurafenib y TTF. Con base en la respuesta a vemurafenib y se pensó que la sinergia podía lograr una eficacia prolongada, se agregó el inhibidor de MEK, trametinib. La combinación inhibitoria de BRAF y MEK demostró ser intolerable para el paciente, por lo que todo el tratamiento se mantuvo durante 1 mes. Luego, se reanudó vemurafenib junto con TTF. Después de 2 meses con el régimen descrito anteriormente, hubo una respuesta parcial adicional en el orden de una reducción adicional del 70% del tumor potenciador. El régimen se continuó y después de 4 meses de tratamiento hubo una disminución adicional en el tamaño del tumor con una mejoría clínica parcial. ( ) Desafortunadamente, la respuesta no se mantuvo y el paciente murió de enfermedad progresiva durante 37 semanas después de iniciar el régimen de vemurafenib y TTF.
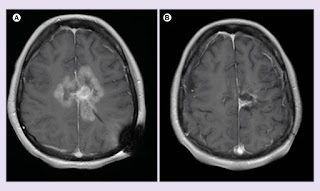
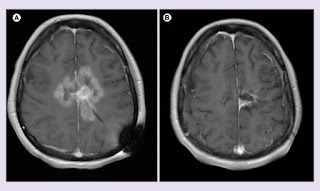
Figura 1.
MRI antes y después del tratamiento con inhibidor de BRAF y campo de tratamiento de tumores concurrentes.
Imágenes de RM axial post contraste T1 de (A) 7 de febrero de 2017 y (B) 8 de agosto de 2017.
Como el paciente había fallecido, este informe se consideró exento de revisión por parte de la junta de revisión institucional.
Discusión
PXA a menudo indolente, tiene el potencial de recurrir. El trabajo reciente en PXA señala una supervivencia de 3 años de 80.2% y 5 años de supervivencia del 74%. La supervivencia libre de progresión es del 66,5% a los 3 años y del 60,5% a los 5 años [ 13 ]. La PXA recurrente puede ser muy refractaria al tratamiento. Aunque nuestro caso puede no imitar la historia natural de la mayoría de PXA, no es representativo de un valor atípico esotérico ya que un porcentaje sustancial de pacientes experimentará una progresión de la enfermedad y la muerte en menos de 5 años. Progressive PXA carecen de opciones de tratamiento adecuadas.
Los inhibidores de BRAF han demostrado ser beneficiosos en el tratamiento de tumores, incluidos los melanomas con mutaciones BRAF . TTF ha demostrado eficacia en glioblastoma, un tumor cerebral de alto grado [ 8-12 ]. En el caso descrito anteriormente, se tomó ventaja de un objetivo molecular específico (mutación V600E BRAF ) que se encuentra comúnmente en estos tumores. El uso de TTF para PXA ha sido reportado en forma de resumen [ 14], pero hasta donde sabemos, no ha sido reportado previamente en la literatura revisada por pares. Debido a la falta de toxicidades superpuestas conocidas, se tomó la decisión de agregar TTF al régimen. No se detectó señal de seguridad adicional. Sin embargo, la adición de un inhibidor de MEK a este régimen demostró ser intolerable para nuestro paciente. El régimen demostró una mejora radiográfica notable en este tumor extremadamente resistente al tratamiento. Desafortunadamente, la respuesta no fue sostenida. Debido a la naturaleza combinada del régimen de tratamiento, es imposible atribuir a un agente específico ningún resultado favorable. También es imposible discernir cualquier sinergia potencial entre las dos modalidades terapéuticas. En nuestro caso, la combinación parecía relativamente segura y se asoció con una respuesta parcial sostenida de la enfermedad.
Notas a pie de página
Divulgación de intereses financieros y competitivos
Los autores no tienen afiliaciones relevantes o participación financiera con ninguna organización o entidad con un interés financiero o conflicto financiero con el tema o los materiales discutidos en el manuscrito. Esto incluye empleo, consultorías, honorarios, acciones u opciones de propiedad, testimonios de expertos, concesiones o patentes recibidas o pendientes, o regalías.
No se utilizó asistencia de escritura en la producción de este manuscrito.
Revelación de consentimiento informado
Los autores afirman que no se pudo obtener el consentimiento por escrito dado que el paciente ha fallecido. Los autores afirman que es la política de IRB de su institución renunciar al consentimiento para la publicación de tales casos.
Acceso abierto
Este trabajo está licenciado bajo la licencia Creative Commons Attribution 4.0. Para ver una copia de esta licencia, visite http://creativecommons.org/licenses/by/4.0/
Referencias
1. Ida CM, Rodriguez FJ, Burger PC, y col. Xantoastrocitoma pleomórfico: historia natural y seguimiento a largo plazo. 2015; 25 (5): 575 - 586. [ Artículo gratuito de PMC ] [ PubMed ]
2. Dias-Santagata D, Lam Q, Vernovsky K, y col. Las mutaciones BRAF V600E son comunes en el xantoastrocitoma pleomórfico: implicaciones diagnósticas y terapéuticas. 2011; 6 (3): e17948. [ Artículo gratuito de PMC ] [ PubMed ]
3. Chamberlain MC. Terapia de rescate con inhibidores de BRAF para xantoastrocitoma pleomórfico recurrente: una serie de casos retrospectivos. 2013; 114 (2): 237-240. [ PubMed ]
4. Hyman DM, Puzanov I, Subbiah V, y col. Vemurafenib en múltiples cánceres no melanoma con mutaciones V600 BRAF . 2015; 373 (8): 726-736. [ Artículo gratuito de PMC ] [ PubMed ]
5. Lee EQ, Ruland S, NR LeBoeuf, Wen PY, Santagata S. Tratamiento exitoso de un xanthoastrocitoma pleomórfico anaplásico mutante progresivo BRAF V600E con monoterapia con vemurafenib. 2016; 34 (10): e87-e89. [ PubMed ]
6. Usubalieva A, Pierson CR, Kavran CA, y col. Xantoastrocitoma pleomórfico primario de la meninge con características anaplásicas: un informe de 2 casos, uno con mutación BRAF (V600E) y respuesta clínica al inhibidor de BRAF dabrafenib. 2015; 74 (10): 960 - 969. [ Artículo gratuito de PMC ] [ PubMed ]
7. Brown NF, Carter T, Mullholand P. Dabrafenib en xantoastrocitoma pleomórfico anaplásico mutado BRAF V600. 2017; 6 (1): 5-9. [ Artículo gratuito de PMC ] [ PubMed ]
8. Stupp R, Taillibert S, Kanner AA, y col. Terapia de mantenimiento con campos de tratamiento de tumores más temozolomida frente a temozolomida sola para el glioblastoma: un ensayo clínico aleatorizado. 2015; 314 (23): 2535-2543. [ PubMed ]
9. Stupp R, Taillibert S, Kanner A, et al. Efecto de los campos de tratamiento de tumores más temozolomida de mantenimiento versus temozolomida de mantenimiento solo en la supervivencia en pacientes con glioblastoma: un ensayo clínico aleatorizado. 2017; 318 (23): 2306 - 2316. [ Artículo gratuito de PMC ] [ PubMed ]
10. Stupp R, Wong ET, Kanner AA, y col. NovoTTF-100A versus quimioterapia de elección médica en el glioblastoma recurrente: un ensayo aleatorizado de Fase III de una nueva modalidad de tratamiento. 2012; 48 (14): 2192 - 2202. [ PubMed ]
11. Hoettinger AF, Pacheco P, Stupp R. Campos de tratamiento de tumores: una nueva modalidad de tratamiento y su uso en tumores cerebrales. 2016; 18 (10): 1338 - 1349. [ Artículo gratuito de PMC ] [ PubMed ]
12. Mrugala MM, Ruzevick J, Zlomaczuk P, Lukas RV. Campos de tratamiento de tumores en la práctica neuro-oncológica. 2017; 19 (8): 53. [ PubMed ]
13. Tonse R, Gupta T, Epari S, et al. Impacto de la actualización de la OMS 2016 sobre la clasificación de los tumores cerebrales, los marcadores moleculares y los resultados clínicos en el xantoastrocitoma pleomórfico. 2018; 136 (2): 343 - 350. [ PubMed ]
14. Iqbal M, Turner S. xantoastrocitoma pleomórfico con características anaplásicas: informe de un caso. 2016; 18 (Suplemento 6): vi167.
Artículos de la Oncología del SNC se proporcionan aquí cortesía de Future Science Group